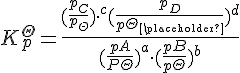实验平衡常数
![]()
(浓度) (分压) (标准下)
Kc与温度相关
Δn=0,Kc无单位。
Δn≠0,Kc有单位。
Kc越大说明反应进行的越彻底
同一道方程式,如N2O4===2NO2
与1/2N2O4===NO2
Kc1=Kc2的平方
推广:aA+bB===cC+dD与
a/xA+b/yB===c/zC+d/wD
则有Kc1=Kc2的......次方(算不出来)
Kc适用于溶液中的反应(因为方便,没说气体不行,但气体一般使用分压来计算)
Ka (酸的浓度平衡常数)
Kp≠Kc
Δn=0,Kp无单位。
Δn≠0,Kp有单位。
PV=nRT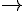 c=P/RT
c=P/RT
![]()
此公式仅适用于气相反应
标准平衡常数![]()
对于气相方程:![]()
则有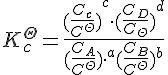
K---![]() 数值不变
数值不变
对于液相方程:
(略)
则有